目次
■ガソリンエンジン車の電源として長く活躍
●能力はニッケル水素やリチウムイオンに劣る
車載2次電池は、電気エネルギーを供給する放電や、逆に得られたエネルギーを電気として充電できる電池です。エンジンを搭載している標準車では、安価で取り扱いが容易な鉛電池が使われます。
クルマに安定した電力を供給するために放電と充電を繰り返す鉛電池について、解説していきます。
●2次電池の基本
自動車用の電池は、正極と負極で別々に起こる酸化・還元反応を利用した化学電池で、充電による蓄電ができる2次電池です。
充電することによって電気エネルギーを化学エネルギーの形で蓄え、放電時には化学エネルギーを再度電気エネルギーに変換して、充放電を繰り返すことができます。
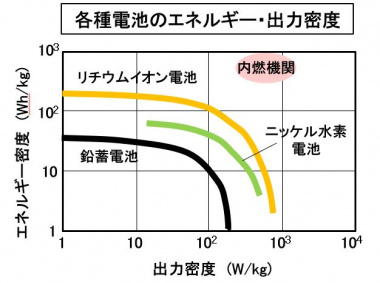
鉛電池は、電動車で使用されているニッケル水素電池やリチウムイオン電池に比べると、エネルギー密度・出力密度で劣っています。大電力の充放電をしない標準車では、安価で信頼性の高い鉛電池が使用されています。
●電池の能力を測る指標
電池の能力を示す指標には、次のようなものがあります。
・バッテリ容量 (Ah)
蓄電可能なエネルギーで、一定の電流値で何時間放電できるかの指標です。例えば、容量10Ahとは、10Aの放電を1時間持続できる電気エネルギーを示しています。
・充電率 (%)
満充電100%に対する充電量の割合を、充電率(SOC:State of Charge)として表します。
・エネルギー密度 (Wh/kg)
電池重量あたりの蓄電可能なエネルギーです。EVでは、満充電時の航続距離に関係します。
・出力密度 (W/kg)
電池重量あたりの瞬時に入出力できる電力です。瞬発力、加速性能を示すので、HEVで重視されます。
●鉛電池の充放電特性
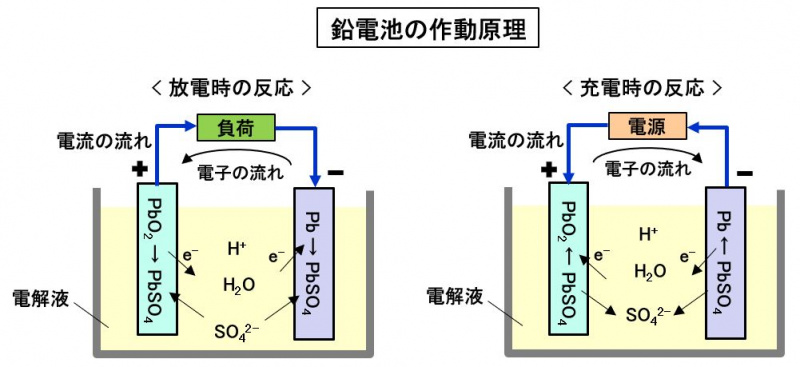
鉛電池セル(1対の陽極と陰極の組み合わせ)の発生電圧は約2Vです。鉛電池は、セル6個を直列につないでパッケージングして出力を12Vにしています。
正極は二酸化鉛PbSO2、負極は金属鉛Pb、電解質は希硫酸H2SO4で構成され、充放電では以下の化学反応が起こります。
放電) Pb + PbO2 → 2PbSO4 + 2H2O 充電) Pb + PbO2 ← 2PbSO4 + 2H2O
ここで、放電時は負極で電子を与える酸化反応、正極で電子を受け取る還元反応が起こり、電子が負極から正極に移動し、電流が流れます。
充電時はこれと逆の反応となり、逆方向に電子が流れ、電流が流れます。
鉛電池は、繰り返し充電することによって、負極に硫酸鉛の結晶が発生しやすく、性能が低下しやすい欠点があります。したがって、充放電量には制約があり、過放電にならないように走行中はオルタネーター(発電機)によって精度良く充電制御しています。
●鉛電池の性能評価
放電時は、両極板に硫酸鉛(2PbSO4)とともに水も発生します。したがって、放電すると電解液の硫酸濃度が下がるので、電解液の比重を計測すると電池の放電状態が分かります。
満充電時の電解液の比重は1.26、完全放電で1.06です。放電と充電を繰り返すと比重は徐々に低下するので電解液の比重を計測すれば、その時点での鉛電池の性能が評価できます。
正確な評価ではありませんが、性能の目安として一般的に採用されている手法です。
●鉛電池の劣化
鉛電池は、長年の使用によって経年劣化して内部抵抗が増加します。経年劣化については、比重計測だけでは評価できません。
劣化については、電池に大きな負荷をかけた時の電圧降下で判断します。一般に始動時の電池電圧が9.6V以上あれば、問題ないと判断します。
鉛電池は、150年以上も基本的な構造が大きく変わることなく、現在も使用され続けています。外見は変わらなくても、電装部品の多種多様化による消費電力の増大や電動化部品の搭載などに対応しながら性能は大きく進化しています。
(Mr.ソラン)