目次
■電解質によって4つに大別できる
●自動車には固体高分子型が最適
燃料電池車(FCV)の心臓部である燃料電池(FC)は、充放電を繰り返して使う電動車用の2次電池とは異なり、自ら電気を発電する「発電装置」です。
水素を燃料として酸素との化学反応によって発電する燃料電池の基本原理から課題まで、解説していきます。
●燃料電池の種類
燃料電池には、いくつかの種類がありますが、基本的な概念や仕組みは同じで、使用する電解質によって作動温度や効率が変わります。代表的なものとしては、固体高分子型(PEFC)とリン酸型(PAFC)、溶融炭酸塩型(MCFC)、固体酸化物型(SOFC)の4種類があります。
その中で小型で軽量な固体高分子型燃料電池(PEFC)が、家庭用エネファームや自動車用燃料電池として使われています。PEFCの発電効率は30~40%と他に比べて低いですが、小型軽量に加えて作動温度が常温~90℃と低く、起動が速いといった取り扱い易いメリットがあります。
●燃料電池の仕組み
燃料電池は、「水の電気分解」と逆の反応を利用します。すなわち、水素と酸素を化学反応させて電気を取り出します。
一般に化学エネルギーは、いったん機械エネルギーに変化してから電気エネルギーに変換する場合が多いですが、燃料電池は化学エネルギーを直接電気エネルギーに変換するので効率が高いというメリットがあります。
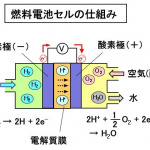
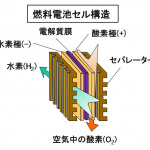
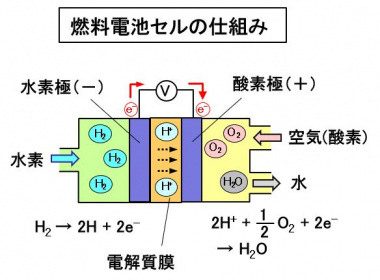
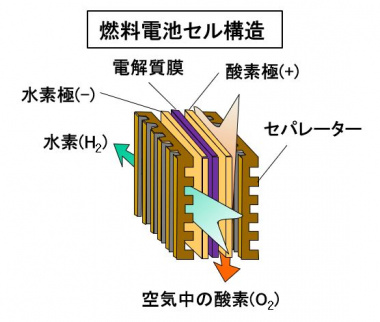
電池セルは、水素が供給される水素(-)極、空気中の酸素が供給される酸素(+)極と、2つの電極に挟まれた固体高分子の電解質膜で構成されています。1つのセルで発生する電圧は、1V以下と低いので、数百のセルを直列接続して電圧を高めます。セルを集めたユニットは、電池スタックと呼ばれます。
●燃料電池の作動原理
高圧水素タンクから水素極に供給された水素は、電極中の触媒作用によって2個の電子(e-)が放出され、水素イオン(H+)になります。その電子が外部回路を通じて反対側の酸素極に流れることで、電流が流れて電気が発生します。
水素酸化反応) H2 → 2H+ + 2e-
一方酸素極では、供給された空気中の酸素(O2)が、外部回路から流れてきた電子(e-)を受け取り、酸素イオン(O2-)になります。この酸素イオンは、電解質膜を移動してきた水素イオン(2H+)と結合して、水(H2O)になります。
酸素還元反応) 2H+ + 1/2・O2 + 2e- → H2O
水素電極の水素酸化反応と酸素極の酸素還元反応は、常温~120℃程度では起こらないので、これらの反応を促進するため、電極(カーボン)には白金などの触媒層が担持されています。これが、燃料電池の高コストの一因であるため、白金などの貴金属を減らすことが現在重要な課題のひとつになっています。
●エネファームと車載用燃料電池の違い
「家庭用燃料電池コージェネレーションシステム」のエネファームは、既に実用化が進んでいます。一般家庭用の自家発電設備で、都市ガスやLPガスなどから水素を取り出し、燃料電池を稼働するシステムです。水素の取り出しは、触媒を使った燃料改質器で行います。
自動車用の燃料電池でも、かつては改質器を搭載したオンボード型の開発が進められていましたが、効率の課題が解決できず現在はほとんど採用されていません。
燃料電池は、水素を燃やすことなく直接的に電気を取り出せるため、理論的には水素の持つエネルギーの80%程度を電気エネルギーに変えることができ、ガソリン車の2倍以上の効率があります。
技術的な課題は克服されつつありますが、高価な電極触媒と電解質膜の低コスト化が今後の開発のカギとなっています。
(Mr.ソラン)